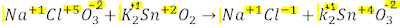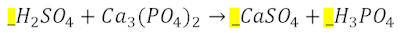- ¿QUÉ ES UNA REACCIÓN QUÍMICA?
Es tan sencillo como decir que, es la unión, mezcla o reacción de dos o más sustancias, obteniendo otras nuevas. Y si tu maestro te sale con un choronoonon no te confundas, es así de sencillo, la unión, mezcla o reacción de dos o más sustancias, obteniendo otras nueva.
- TIPOS DE REACCIONES QUÍMICAS
>SÍNTESIS:
Cuando dos o más reactivos, forman una única sustancia:
 >DESCOMPOSICION:
>DESCOMPOSICION: Una única sustancia se descompone en otras más sencillas, al calentarla o mediante electrolitos:

>SIMPLE DESPLAZAMIENTO O SUSTITUCION:
Un elemento desaloja a otro de un compuesto y lo deja libre:
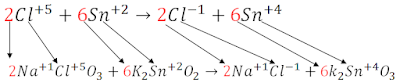
 >DOBLE DESPLAZAMIENTO O SUSTITUCIÓN:
>DOBLE DESPLAZAMIENTO O SUSTITUCIÓN: Los átomos de dos sustancias intercambian sus posiciones originando dos compuestos nuevos:

- ¿QUÉ ES UNA ECUACIÓN QUÍMICA?
Es la representación simbólica de las reacciones químicas.
- SIMBOLOGÍA DE LAS ECUACIONES:

- LEY DE LA CONSERVACIÓN DE LA MATERIA:
“En toda reacción química la masa se conserva, es decir la masa consumida de los reactivos es igual a la masa obtenida de los productos”